Pillola anti-covid, Merck avvierà l'iter autorizzativo: -50% del rischio di ospedalizzazione
di Marco Innocenti
Bassetti: "Il San Martino primo e unico centro in Italia che ha arruolato un paziente nello studio. Viva la ricerca e viva la scienza"
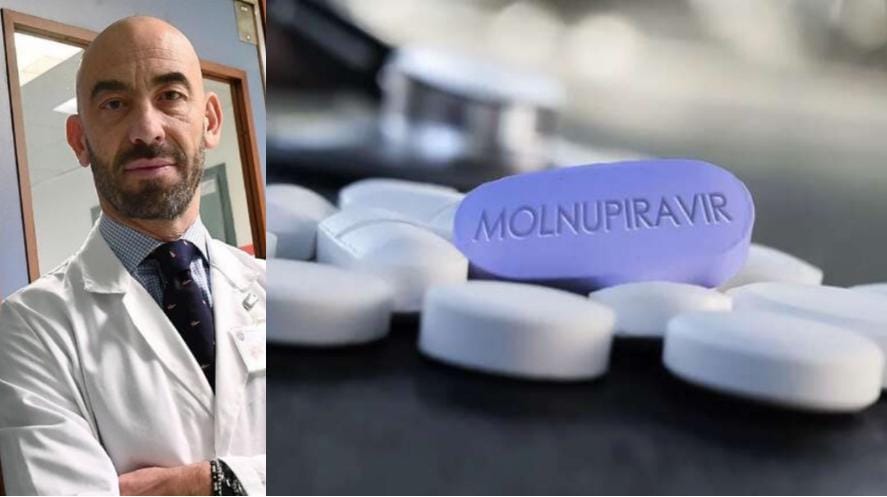
In principio era solo Pfizer ma la notizia che anche Merck si appresta ad avviare l'iter autorizzativo d'emergenza per il via libera alla commercializzazione della prima pillola anti-covid ha subito fatto il giro del mondo. Secondo quanto affermato dall'azienda stessa, la pillola andrà somministrata nelle prime fasi dell'infezione a pazienti ad alto rischio di complicazioni covid, quattro compresse al giorno per cinque giorni. "Il farmaco - afferma ancora l'azienda - ha ridotto di circa il 50% il rischio di ospedalizzazione o di morte in base ai risultati dell’interim analysis della fase III del trial MOVe-OUT condotto su pazienti adulti non ospedalizzati a rischio con COVID-19 in forma lieve o moderata”.
"È con grande soddisfazione che condivido i risultati preliminari dello studio sul farmaco Molnupiravur (una pastiglia) per la cura dei pazienti Covid - ha scritto anche Matteo Bassetti sul suo profilo Facebook - Dalla analisi dei dati revisionati in Interim Analysis 4, è emersa una chiara validità del farmaco di studio (MOLNUPIRAVIR) nel ridurre i casi di ospedalizzazione e/o morte del circa 50%. Lo studio viene quindi interrotto anticipatamente visti i risultati e Merck chiederà autorizzazione a FDA per approvazione all’utilizzo. Al San Martino siamo stati il primo e unico centro italiano che ha arruolato un paziente nello studio. A breve avremo quindi una nuova opportunità per trattare a casa i pazienti con il Covid. Viva la ricerca e la scienza".
Per restare sempre aggiornati sulle principali notizie sulla Liguria seguiteci sul canale Telenord, su Whatsapp, su Instagram, su Youtube e su Facebook.
Condividi:
Altre notizie
Influenza, campagna vaccinale record in Liguria: 340 mila dosi, minore impatto sugli ospedali
06/02/2026
di Anna Li Vigni
Giornata mondiale contro il cancro, focus con gli specialisti
05/02/2026
di Maurizio Michieli

Uil Fp Genova: "Non escludiamo stato di agitazione su riforma sanitaria"
03/02/2026
di R.S.

Cardiologie aperte, mercoledì 11 febbraio esami gratuiti su prenotazione
02/02/2026
di m.m.





